我が国の医薬研究開発を推進して経済成長にもつなげようと、日本再興戦略と連携する大きな期待を背負って日本版NIH(注1)が発足する。今回は、日本版NIHがそうした期待に応えられるのかどうかを検証してみたい。
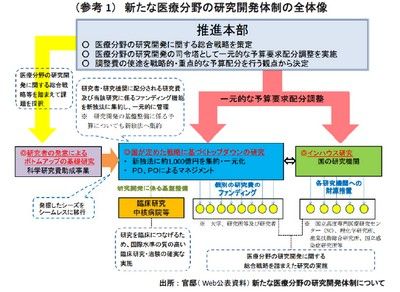
日本版NIH構想とは、正式には「健康・医療戦略推進本部」と新しい独立行政法人(独法)の「日本医療研究開発機構」の設置であり、これによって医療分野の研究開発戦略の一元化(司令塔機能)と成果志向の研究開発推進を狙っている。具体的には、推進本部は総合戦略に基づき、戦略的・重点的な予算配分を行う。国として戦略的に行うべき実用化のための研究予算について、文部科学省(科研費(注2)を除く)・厚生労働省・経済産業省の研究開発予算配分機能を新独法に集約し、一元的に管理するとされている(参考1)。
業界に詳しい知人へのヒアリングを踏まえ、課題と期待を整理してみた。
1. 「司令塔機能」の実現は不可能ではないか?
我が国の科学技術研究政策に詳しいA先生のご意見をうかがったところ、予算要求の調整を含む同じような司令塔役の期待を受けて創設された総合科学技術会議が役割を果たせなかった前例があり(注3)、今回も機能しないだろう、とのことだった。筆者の大学時代の友人で大手製薬企業の研究所長を務めるB君は「予算の統合も重要だが、戦略・評価システムの統合のほうがもっと重要。こうした改革では司令塔機能は生まれない。」と言い切る。
2. 予算配分方法・方針を変えた程度では、大きな成果はすぐには生まれそうにない
同じく大学時代の友人で大学で医・薬研究に関わっているC先生にうかがったところ、文科省の科研費が統合されないせいか、よくも悪くも、現場には何かが変わるという切実感はないようだった。先出のA先生も「成果を基準に研究費配賦に優先順位をつければ成果志向をリマインドすることになり、ややもすれば趣味的研究ばかりしかねない一部の研究者にとっては良い刺激にはなろうが、だからといって急に画期的な成果が上がるわけではない」というご意見だった。
3. 臨床研究にも抜本的な改革が必要だ
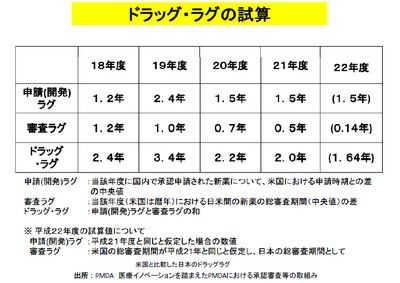
我が国の臨床研究の問題は危機的状況といえ、その主因とされるのがドラッグラグ(注4)や治験コストの高さである。最近若干短期化の方向だが、我が国のある大手製薬企業は、既に医薬開発(ヒト臨床試験フェーズ1以降)のヘッドクォーター機能を米国に移しているという。
このままでは、医薬シーズ開発の動物実験までは国内で成功したところで、国内での製品化は難しそうだ。ベンチャーによる創薬の場合は、なおさらだろう。そうした中、薬事申請時のこうしたハードルを少しでも下げるため、Pre-PMDA(注5)と呼ばれる各種支援を提供しようという動き(注6)が見られるので、期待したい。また、2016年度から治験データを米国FDA推奨の電子データフォーマットで提出することが義務付けられる予定だが、それを機に臨床試験データのデータベースとしての共有化を推し進め、治験期間の短縮や費用軽減につなげようという取組みにも希望を感じる。
4. 成果志向の行き過ぎにはデメリットもありそうだ
「(ブレーキペダルのような)アソビ」のない成果志向主義にはデメリットもあるだろう。基礎研究には目先の成果を目標とするのでなく、地道に礎石を積み上げて行く面がある(注7)からだ。科研費のバラマキ体質が問題にされることが多いが、良識ある大学の先生は、そうした自由な小口経費を学生の教育目的に活用している。限られた研究開発予算の配分にこうしたアソビがなくなると、コツコツ研究している大学研究者にしわ寄せが行き、多くの研究者が研究を諦めなくてはならなくなる可能性がある(注8)。その結果、世界と競争して勝てる研究成果は確かに増えるかもしれないが、独創性の高い研究は減る危険がある。元来、研究には失敗がつきものである。成功しそうなことだけやっていては画期的な成果は生まれない。製薬企業のB君の「日本のアカデミアの先生には、短期に創薬等の成果に結びつけようとするより、時代を変えるような画期的な研究を目指して欲しい。」という意見に共感を覚える。
このように、日本版NIHが我が国の経済をすぐにけん引してくれると期待するのは早計のようだ。少なくとも、地道な基礎研究むけの予算が減額とならないよう、研究開発予算総額の大幅な増額が必要だろう。国内の治験の効率化にむけた取組みやベンチャーをさまざまに支援するエコシステムも非常に重要である。このように課題は多いが、我が国で発見された技術シーズの治験が国内で最初に行われ、国内で最初に製品化される、そんな医薬研究開発の進展に期待したい。
(注1) 本家米国のNIHのほうは、予算規模が日本版NIHの10倍以上であるうえ、基礎研究もしっかりサポートする等、もっと幅広く重要な役割を担っている。それに比べると、日本版NIHのほうの役割は、統合した予算の戦略分野への重点的配分に限定される。こうした違いに鑑み、現在では国としても日本版NIHという名称を使わないことにした、と報道されている(2014年2月26日付日本経済新聞ほか)。
(注2) 科学技術研究費補助金。一般に科研費と呼べば文科省のものを指すが、実は厚労省にも同じ趣旨の科研費があり、厚労科研費については今回の統合の対象となっている。
(注3) 例えば、総合科学技術会議は自前の予算と調査能力が不足しており、近年は特に予算要求における財務省への影響力が低下していた。また、科学技術基本計画があるのに「科学技術イノベーション総合戦略」も策定する等、戦略が乱立し、真に注力する分野がどこにあるのかが分かりにくくなっていたのかもしれない。
(注4) 書類を受理してからの審査期間については米国との差は縮んでいるものの、書類受付までの間の日本語資料の用意等に時間を要している面がある。ところが実は、そうした和訳資料を希望するのは、役所/承認機関でも医師でもなく、臨床試験受託企業や薬剤師だという。
(注5) PMDA:(独)医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency)。医療現場で使用する医薬品や医療機器、日常生活で使用する一般用医薬品や医薬部外品について、品目ごとに品質・有効性・安全性を審査する等の業務を行う。
(注6) 例えば、http://kslion.org/project/prepmda/index.html
(注7) 本家NIHの場合は、補助金の対象とする研究の入口を広く、出口を狭くした「多段階選抜方式」の活用により(研究に失敗はつきものだ、との前提)、この問題を克服していると考えられる。研究が出口に近づくにつれ、そのベンチャー化をサポートするさまざまなエコシステムも存在する。
(注8) 例えば、国家プロジェクトを推進できるスター研究者のチーム以外にはお金がつきにくくなると、そうしたチームに学生レベルの研究者を参画させることが難しくなり、学生を育てることができなくなる。
コラム執筆:チーフ・アナリスト 松原 弘行/丸紅株式会社 丸紅経済研究所
■ 丸紅株式会社からのご留意事項
本コラムは情報提供のみを目的としており、有価証券の売買、デリバティブ取引、為替取引の勧誘を目的としたものではありません。
丸紅株式会社は、本メールの内容に依拠してお客様が取った行動の結果に対し責任を負うものではありません。
投資にあたってはお客様ご自身の判断と責任でなさるようお願いいたします。