第88回のコラム(http://lounge.monex.co.jp/advance/marubeni/2014/06/03.html)では、いわゆる日本版NIH構想だけでは、画期的創薬等の医療産業の興隆は難しそうであることを説明した。研究費については、配分方針の変更ではなく予算総額を増やし、基礎にも応用にも研究費をつける必要がある。また、ドラッグラグという表現に代表される我が国の医薬等承認プロセス全体の改革も不可欠である。今回は日本の医薬市場での「意外な」期待感の高まりと、現状改革に向けた具体的な取組みについて紹介する。
1. 我が国の医薬市場の魅力が相対的に高まっている
前回は、我が国の大手製薬企業が治験以降を担う開発拠点を既に米国に移してしまっている点を挙げ、日本発の医薬シーズさえ我が国で医薬として上市されない可能性を危惧した。一方で、昨今は日本市場の魅力が相対的に高まり、画期的新薬を開発する欧米の製薬企業があらためて我が国での承認取得・製品上市に強い関心を示すようになっているという。人口減少時代に入った我が国が注目されるのはなぜだろうか?
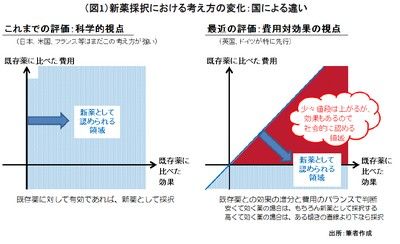
ひとつには、英国やドイツでは、いくら薬効そのものが大きくても費用対効果が悪いと、新薬として承認はされても保険償還されなくなっているからである。これらの国々では「従来の医薬品のビジネスモデル」が崩壊した、とさえ言われる。我が国では、画期的な新薬であればコスト積上げで薬価が認められる(図1)。また、米国は、新薬の価格を他国より高く企業が決めることができる最大かつ最重要市場であることは変わっていないものの、後発医薬品(ジェネリック)が発売されれば半年で大半の売上げを失う厳しい市場でもある。日本は、市場規模がそこそこ大きく、薬効が高ければ薬価もまずまずつき、後発品はまだ大きな脅威となっていないため、安定的な魅力が感じられるようだ。このように、日本市場の魅力が「相対的に」高まっている(注1)ことによって、欧米企業が我が国での承認取得と製品上市をあらためて重要視してきている。
2. ドラッグラグの本質と解消にむけた取組み
我が国の大手製薬企業が日本離れをしている(ように見える)原因の1つがドラッグラグや治験コストの高さにあることを前回説明した。そうした危機的状況は改善し、製薬企業の日本市場への注目度に応えられるようになっているのだろうか?
慶應義塾大学グローバルセキュリティ研究所の辻香織の研究(注2)によれば、我が国のドラッグラグの本質は、PMDAや厚労省の審査期間や治験期間の長さによるのではなく、海外での承認/販売開始を待ってから国内のライセンス先を決める商慣習や、海外での承認取得を終えてから国内で承認申請を行う、企業のビジネス判断によるものだ、という(注3)。確かに、書類受理後の審査期間だけについていえば、既に我が国のラグはほぼゼロで、EUよりはむしろ短くなっている。
ドラッグラグの本質が海外製薬企業による申請・上市の躊躇であり、そうさせる具体的障壁は日本独自ルールや英語が通じない点なのだとすれば、2016年度から治験データを英語の電子データフォーマットCDISCで提出することになるのは、海外企業にとっては強い追い風だ(注4)。さらに、書類提出までの事前相談に時間を要している点について、受験予備校的な事前相談窓口は、国内外の製薬企業や特に創薬ベンチャーにとって大きな助けになるだろう。NPOライフイノベーション総合支援機構は、京浜臨海部ライフイノベーション国際戦略総合特区での横浜市の委託による薬事相談等支援事業(http://kslion.org/project/prepmda/index.html)に取り組んでいる。
3. 治験の効率改善にむけた取組み
では、我が国の治験効率の悪さの点はどうだろう。
CDISCの導入により、臨床試験データが電子データベース化されると、データの有効活用が可能となり、治験期間の短縮や費用軽減につながることが期待される。
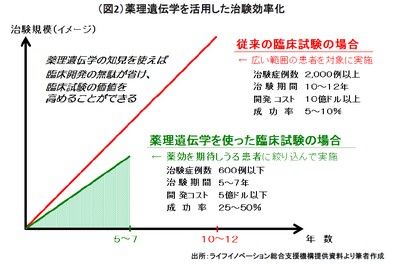
さらに、電子化された臨床試験データにゲノム(遺伝子)情報等の広汎な生体・ゲノム・病歴情報をリンクさせれば(注5)、効率的な治験のデザインが可能になる。具体的には、患者のそうした情報を基準に、どんなタイプの患者であればその薬が効きそうか事前に識別しておき、患者を絞り込んだ治験を行うことによって、治験の症例数を少なくでき、治験期間も短縮され、開発コストが大幅に削減できるとされる(図2)。
こうして開発コストが下がれば、費用対効果も改善し、希少疾患の治療薬を含めた医薬品アクセスの改善が期待できる。
我が国の製薬業界にも、わずかながら光明が見えてきたようである。こうした流れが確かなものとなるよう、特に電子データ活用による治験効率の改善の点で、産官民関係者の取組みの進展に期待したい。
(注1)我が国は「まだ」英国やドイツほど顕著な費用対効果至上主義の立場に立っていないが、考え方は既に導入されている。従って、今は相対的に高まっている日本市場の魅力も一時的なものかもしれない。なお、費用対効果評価には「革新的新薬の利用の遅れ」、「アクセス制限・遅れ」、「採算割れ懸念による新薬上市見合わせ」といった問題点も指摘されている。
(ご参考:http://www.jpma.or.jp/event_media/forum/repo_35.html)
(注2)薬理と治療 37巻 6号(ライフサイエンス出版)「日本におけるドラッグラグの現状と要因―新有効成分含有医薬品398薬剤を対象とした米国・EUとの比較―」
(ご参考:http://www.lifescience.co.jp/yk/jpt_online/review0906/index_review.html)
(注3)リスクを負いたくない日本企業の商慣習(敗者復活のない社会システム)、横並び意識の弊害がここにも表れている。また、海外での審査結果を待ったほうが、我が国でも海外と同様承認されるべきであるという「外圧」に利用できたり、米国で高く設定された薬価を参考に国内の薬価を申請できたりする利点があるのかもしれない。
(注4)一方で、日本企業の治験担当者にとっては、最終的な申請書類が引続き日本語であるにも拘わらず、データ管理を英語で行うことになるため、新たに翻訳等の手間が増えてしまう、という事情もあるようだ。
(注5)NPOライフイノベーション総合支援機構では、データベース構築にはOpenClinica(ご参考:https://community.openclinica.com/)というオープンソースのデータキャプチャ・マネジメントソフトを、生体・ゲノム・病歴情報との統合化にはtranSMART(ご参考http://transmartfoundation.org/site/about-us)というソフトの活用を啓蒙中である。
コラム執筆:チーフ・アナリスト松原 弘行/丸紅株式会社 丸紅経済研究所
■ 丸紅株式会社からのご留意事項
本コラムは情報提供のみを目的としており、有価証券の売買、デリバティブ取引、為替取引の勧誘を目的としたものではありません。
丸紅株式会社は、本メールの内容に依拠してお客様が取った行動の結果に対し責任を負うものではありません。
投資にあたってはお客様ご自身の判断と責任でなさるようお願いいたします。